- Autor Alex Aldridge [email protected].
- Public 2023-12-17 13:36.
- Última modificación 2025-06-01 07:36.
Diferencia clave: metano frente a etano
El metano y el etano son los miembros más pequeños de la familia de los alcanos. Las fórmulas moleculares de estos dos compuestos orgánicos son CH4 y C2H6 respectivamente. La diferencia clave entre el metano y el etano es su estructura química; una molécula de etano se puede considerar como dos grupos metilo unidos como un dímero de grupos metilo. Las otras diferencias químicas y físicas surgen principalmente debido a esta diferencia estructural.
¿Qué es el metano?
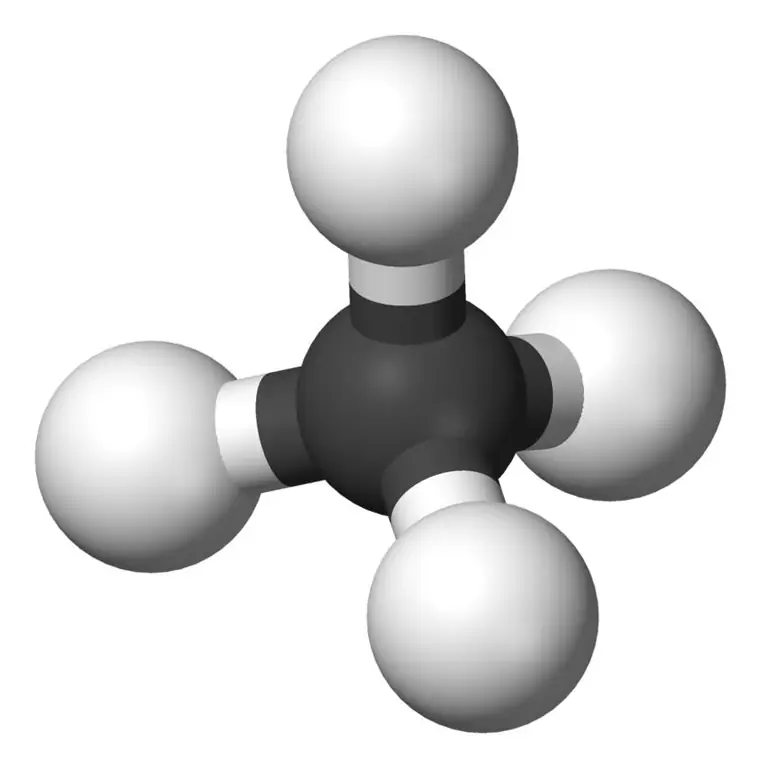
El metano es el miembro más pequeño de la familia de los alcanos con la fórmula química CH4 (cuatro átomos de hidrógeno están unidos a un átomo de carbono). Se considera que es el principal componente del gas natural. El metano es un gas incoloro, inodoro e insípido; también conocido como carbano, gas de pantano, gas natural, tetrahidruro de carbono y carburo de hidrógeno. Puede encenderse fácilmente y su vapor es más ligero que el aire.
El metano se encuentra naturalmente bajo tierra y bajo el fondo del mar. El metano atmosférico se considera un gas de efecto invernadero. El metano se descompone en CH3- con agua en la atmósfera.
¿Qué es el etano?
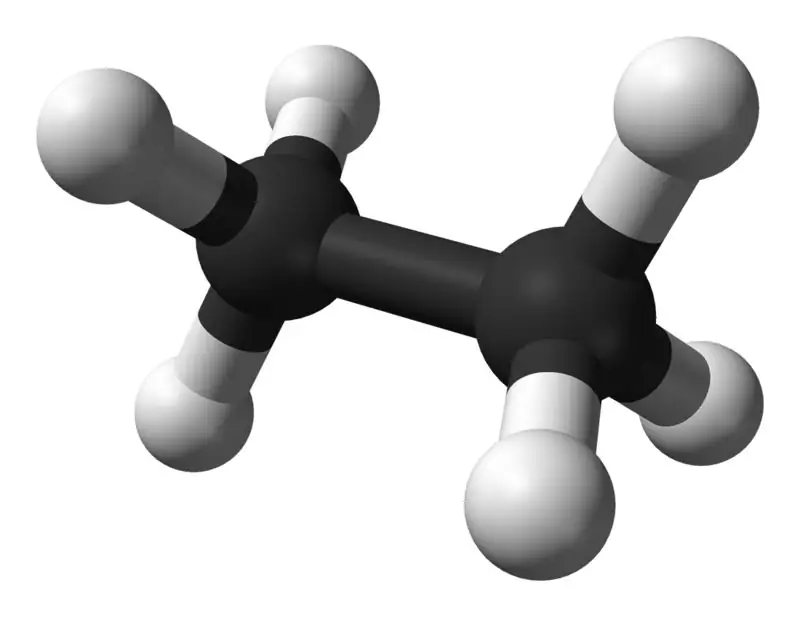
El etano es un compuesto gaseoso incoloro e inodoro a temperatura y presión estándar. Su fórmula molecular y peso molecular son C2H6 y 30,07 g·mol−1 respectivamente. Se aísla del gas natural, como subproducto del proceso de refinación del petróleo. El etano es muy importante en la producción de etileno.
¿Cuál es la diferencia entre metano y etano?
Características del metano y el etano
Estructura:
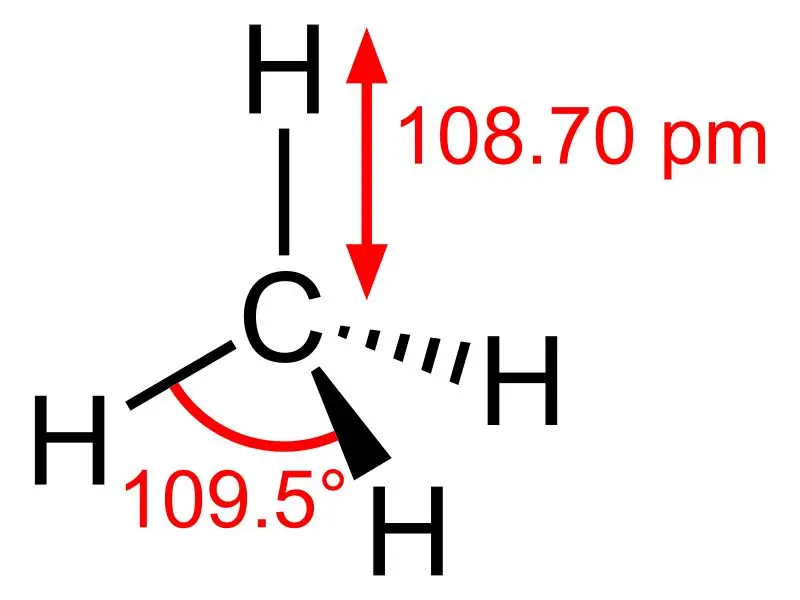
Metano: La fórmula molecular del metano es CH4, y es un ejemplo de una molécula tetraédrica con cuatro enlaces C-H equivalentes (enlaces sigma). El ángulo de enlace entre los átomos de H-C-H es 109,50 y todos los enlaces C-H son equivalentes, y es igual a 108,70 pm.
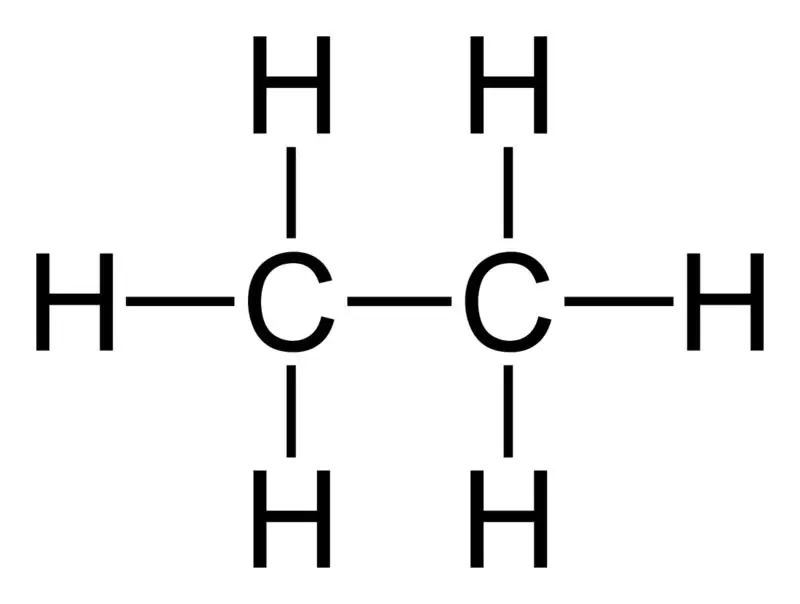
Etano: La fórmula molecular del etano es C2H6,y es un hidrocarburo saturado ya que no contiene enlaces múltiples.
Propiedades químicas:
Metano:
Estabilidad: El metano es una molécula químicamente muy estable que no reacciona con KMnO4, K2Cr 2O7, H2SO4 o HNO 3 en condiciones normales.
Combustión: en presencia de exceso de aire u oxígeno, el metano se quema con una llama no luminosa de color azul pálido que produce dióxido de carbono y agua. Es una reacción altamente exotérmica; por lo tanto, se utiliza como un excelente combustible. En presencia de aire u oxígeno insuficientes, se quema parcialmente en gas de monóxido de carbono (CO).
Reacciones de sustitución: el metano muestra reacciones de sustitución con halógenos. En estas reacciones, uno o más átomos de hidrógeno son reemplazados por un número igual de átomos de halógeno y se denomina “halogenación”.” Reacciona con cloro (Cl) y bromo (Br) en presencia de la luz solar.
Reacción con vapor: cuando una mezcla de metano y vapor pasa a través de un níquel calentado (1000 K) sobre una superficie de alúmina, puede producir hidrógeno.
Pirólisis: cuando el metano se calienta a aproximadamente 1300 K, se descompone en negro de humo e hidrógeno.
Etano:
Reacciones: El gas etano (CH3CH3) reacciona con vapor de bromo en presencia de luz para formar bromoetano, (CH 3CH2Br) y bromuro de hidrógeno (HBr). Es una reacción de sustitución; un átomo de hidrógeno en el etano se sustituye por un átomo de bromo.
CH3CH3 + Br2 à CH3 CH2Br + HBr
Combustión: la combustión completa del etano produce 1559,7 kJ/mol (51,9 kJ/g) de calor, dióxido de carbono y agua.
2 C2H6 + 7 O2 → 4 CO 2 + 6 H2O + 3120 kJ
También puede ocurrir sin exceso de oxígeno, produciendo una mezcla de carbono amorfo y monóxido de carbono.
2 C2H6 + 3 O2 → 4 C + 6 H 2O + energía
2 C2H6 + 5 O2 → 4 CO + 6 H 2O + energía
2 C2H6 + 4 O2 → 2 C + 2 CO + 6 H2O + energía etc.
Definiciones:
Reacciones de sustitución: la reacción de sustitución es una reacción química que implica el desplazamiento de un grupo funcional en un compuesto químico y su sustitución por otro grupo funcional.
Usos:
Metano: El metano se utiliza en muchos procesos químicos industriales (como combustible, gas natural, gas natural licuado) y se transporta como fluido refrigerado.
Etano: El etano se utiliza como combustible para motores y como refrigerante para un sistema de temperatura extremadamente baja. Se envía en cilindros de acero como gas licuado bajo su propia presión de vapor.






